أصدرت إدارة الغذاء والدواء الأمريكية (FDA) وثيقة توجيهية نهائية، بعنوان “اعتبارات لتطوير منتجات الخلايا التائية لمستقبلات المستضد الخيميري (CAR)” في شهر يناير. وفقًا للأغلبية، عندما تم نشر وثيقة التوجيه لأول مرة كمسودة في مارس 2022، تمت إضافة المزيد من الوضوح إلى كل قسم، بما يتوافق مع التعليقات العديدة المقدمة.
بشكل عام، توفر وثيقة إرشادات CAR T ملخصًا ممتازًا ورفيع المستوى للاعتبارات الأساسية للمطورين. يتم توفير عدد قليل من مجالات الشفافية لاعتبارات ذاتية أو خيفية محددة.
لم يتم تناول التوصيات والأمثلة الأكثر تحديدًا للاختيار الأوسع في العلاجات المعتمدة على الخلايا التائية والعلاجات غير المعتمدة على الخلايا التائية والمؤشرات غير السرطانية في هذه الوثيقة وتمثل ثغرات في إرشادات الصناعة الحالية.
مقدمة وخلفية
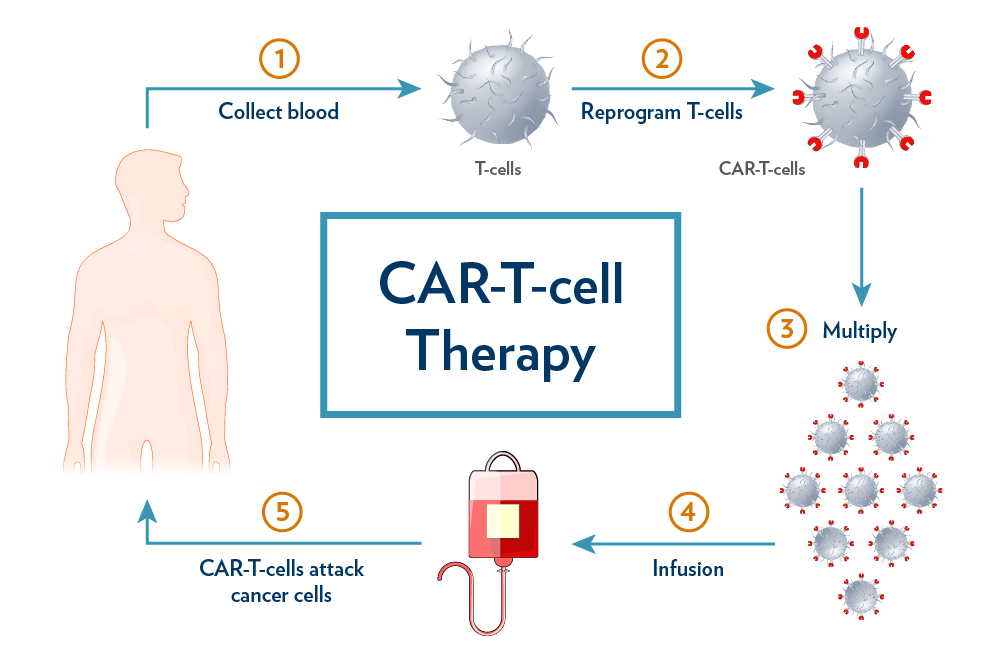
تم تنظيم هذه الوثيقة بتوصيات لدعم المطورين في تصميم وتطوير منتجات CAR T-cell، مع التركيز على مؤشرات الأورام. على الرغم من الطلبات أو التعليقات من عدة مجموعات، لم يتم إجراء أي تغييرات لتشمل توصيات بشأن مؤشرات غير الأورام، وكان توضيح النطاق بمثابة تغيير محدد تم إجراؤه في الوثيقة النهائية.
التوجيه النهائي مع التركيز على منتجات خلايا CAR T المنتجة خارج الجسم الحي، كما اقترحت تعليقات تحالف الطب التجديدي (ARM).
اعتبارات عامة لتصميم وتطوير خلايا CAR T
ركزت التعليقات اهتمامًا خاصًا على القسم الفرعي للمواد الأولية الخلوية، فيما يتعلق بأهمية التوصيات للمرضى الذين ربما تلقوا علاجات سابقة لخلايا CAR T. توصي مسودة المبادئ التوجيهية للاختبار بمنتج فصل الكريات البيض لتقييم وجود خلايا CAR T السابقة والمنتج الدوائي النهائي لتحديد مستويات خلايا CAR T الجديدة والسابقة.
تمت إزالة التوصيات المتعلقة بأهلية المرضى الذين تلقوا سابقًا العلاج بالخلايا CAR T من الوثيقة التوجيهية النهائية.
ردًا على التعليقات المقدمة بشكل جماعي من خلال مجموعة عمل ARM وآخرين، تمت إضافة عدة توضيحات إلى القسم التالي:
هيكل السيارة: مرونة إضافية لوظيفة مجال الإشارة.
الناقل: تم تضمين وصف أكثر شمولاً لتحديد (الناقل) كوسيلة لتوصيل المادة الوراثية.
المنتجات النهائية الطازجة أو المجمدة: تمت معالجة الاعتبارات المتعلقة بالاستقرار أثناء الاستخدام بشكل واضح نظرًا للتأثير المحتمل على مدة صلاحية المنتج وجودته. ويتضمن ضوابط محددة لضمان جودة المنتج أثناء النقل إلى الموقع السريري، مثل إجراءات التوصيف (الشحن والاستلام والتخزين والتحضير للحقن).
توصيات سي إم سي
يتضمن هذا القسم العديد من التغييرات في وثيقة التوجيه النهائية من مسودة التوجيه، ولكن الرسائل الشاملة لم تتغير إلى حد كبير.
بناء المتجهات واختبارها
تمت إضافة توضيح للإشارة إلى أنه يجب التأكد من سلامة وجودة الناقل بشكل كافٍ للبحث السريري، بالإضافة إلى ذلك، تمت الإشارة إلى أنه يجب تصنيع الناقل وفقًا لمعايير GMP “لدراسات المرحلة التالية والترخيص”. هنا، يتم استخدام تعريف أكثر شمولاً للناقل، ولكن على الرغم من المدخلات المباشرة من عدة مجموعات، لم تتم إضافة أي وضوح لمتطلبات الإنتاج لمكونات تحرير الجينات الهامة مثل البلازميدات.
بناء واختبار خلايا CAR T
بشكل عام، تظل التغييرات في هذا القسم طفيفة إلى حد كبير، ويبدو أنها كانت مدفوعة بالتعليقات المنشورة التي تشير إلى عدم الوضوح. وتشمل النقاط البارزة ما يلي:
- توضيح أنه ينبغي تقييم الطرق المناسبة لتأهيل السواغات.
- توضيح أن الإنتاج يجب أن يتم في إطار عملية معقمة مؤهلة.
- بالإضافة إلى ذلك، ينبغي إجراء دراسات لاستخدام وقت التخزين والإدارة للمنتجات الطازجة أو الوقت بين الذوبان والإدارة للمنتجات المجمدة.
قم بصياغة المبادئ التوجيهية الموصى بها لدراسات استقرار خلايا CAR T، لتقييم العمر الافتراضي للمنتج بشكل أكثر دقة.
تم إجراء تغييرات قليلة جدًا خلال قسم الاختبار التحليلي.
توصيات غير سريرية
لم تكن هناك تغييرات كبيرة في محتوى التوصيات غير السريرية. ومن الجدير بالذكر أنه في هذا القسم وفي جميع أنحاء المبادئ التوجيهية، تم استبدال مصطلح “ما قبل السريرية” بمصطلح “غير سريري” للامتثال لقانون إدارة الغذاء والدواء لعام 2022 (FDORA).
التوصيات السريرية
وفي التوجيه النهائي، قدمت إدارة الغذاء والدواء توضيحات توفر بشكل عام المزيد من المرونة للجهات الراعية. وبالإضافة إلى ذلك، أكد التوجيه النهائي على أهمية وجود خطة متابعة ممولة وطويلة الأجل.
خطة علاجية
في مسودة المبدأ التوجيهي، أوصت إدارة الغذاء والدواء الأمريكية في البداية بحساب جرعة خلايا CAR T على أساس وزن الجسم / مساحة سطح الجسم (BSA) بدلاً من استخدام جرعة ثابتة. وقد طلب مركز العلاج المناعي الخلوي من إدارة الغذاء والدواء مراجعة هذه التوصية في تعليقاتها بناءً على تجربتها في استخدام الجرعات المعتمدة على الوزن في تجارب الأورام الصلبة البالغة. وقبلت إدارة الغذاء والدواء الطلب.
تقييم ومراقبة السلامة
وأزالت إدارة الغذاء والدواء الأمريكية توصيتها بمراقبة مستويات السيتوكينات لدى المرضى عند خط الأساس وفي نقاط زمنية محددة مسبقًا، وأشار المعلقون إلى أن نتائج مستوى السيتوكينات في الدم قد لا تكون متاحة في الوقت المناسب لاتخاذ قرارات العلاج، وأن مستويات السيتوكينات في الدم عادة لا تستخدم للاسترشاد بها. خوارزميات إدارة متلازمة إطلاق السيتوكين (CRS).
مصدر:cellandgene
Write Your Comment