أصدرت إدارة الغذاء والدواء الأمريكية (FDA) وثيقة توجيهية نهائية، بعنوان “اعتبارات لتطوير منتجات الخلايا التائية لمستقبلات المستضد الخيميري (CAR)” في شهر يناير. وفقًا للأغلبية، عندما تم نشر وثيقة التوجيه لأول مرة كمسودة في مارس 2022، تمت إضافة المزيد من الوضوح إلى كل قسم، بما يتوافق مع التعليقات العديدة المقدمة. بشكل عام، توفر وثيقة إرشادات CAR T ملخصًا ممتازًا ورفيع المستوى للاعتبارات الأساسية للمطورين. يتم توفير عدد قليل من مجالات الشفافية لاعتبارات ذاتية أو خيفية محددة. لم يتم تناول التوصيات والأمثلة الأكثر تحديدًا للاختيار الأوسع في العلاجات المعتمدة على الخلايا التائية والعلاجات غير المعتمدة على الخلايا التائية والمؤشرات غير السرطانية في هذه الوثيقة وتمثل ثغرات في …
تعتبر بكتيريا المكورات العنقودية المعوية B (SEB) قوية جدًا وتتطلب كميات صغيرة جدًا لممارسة تأثيرها السام مقارنةً بالمواد الكيميائية الاصطناعية. يعتبر SEB مستقرًا للغاية ويمكن إنتاجه بسهولة بكميات كبيرة، مما قد يتسبب في فشل النظام والوفاة. المكورات العنقودية الذهبية المكورات العنقودية المعوية B (SEB) هي سبب شائع للتسمم الغذائي، حيث يبدأ الإسهال الشديد والغثيان والتشنج المعوي غالبًا في غضون ساعات من الابتلاع. السم ثابت تمامًا وقد يظل نشطًا حتى بعد قتل البكتيريا المسببة للعدوى. يمكن أن يتحمل الغليان عند 100 درجة مئوية لعدة دقائق. مثل جميع السموم، يوجد SEB بشكل شائع في الطبيعة. لا يُعرف سوى القليل جدًا عن كيفية حدوث SEB في الطبيعة. وقد …
الفيروس الغدي للطيور (FAdV) ، الذي تم الإبلاغ عنه لأول مرة في أنغاراغوت ، باكستان في عام 1987 ، وفي يونيو 2015 أيضا ، حدث تفشي للفيروس الغدي للدجاج في الصين ، مما تسبب في أضرار اقتصادية كبيرة لصناعة الدواجن. تم الإبلاغ عن عدوى FAdV المرتبطة ب IBH و HHS و GE في جميع أنحاء العالم ، مما تسبب في الكثير من الأضرار الاقتصادية في صناعة الدواجن. وقد تم الآن تطوير أنواع مختلفة من اللقاحات وتقييمها للسيطرة على HHS ، وتم تطوير العديد من اللقاحات وتقييمها. تم إنتاج المركبات السلبية التي قدمت مساهمة مهمة في صناعة الدواجن. النسبة المئوية للوفيات الناجمة عن مرض أنجارا في …
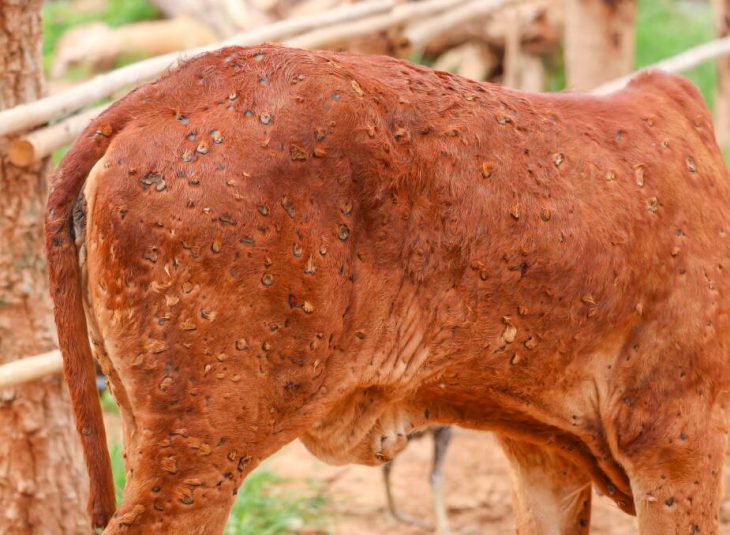
مرض Limpiskin (LSD) هو نوع من فيروس الجدري الماعز الناجم عن لدغات الحشرات للماشية. يظهر مرض Limpiskin بشكل شائع في الصيف والخريف الرطبين عندما يكون البعوض والحشرات مرتفعا ، ويعرف الفيروس علميا باسم Capri poxvirus ، من عائلة Poxviridae. اكتشف الفيروس في الأبقار في عام 1929 في جنوب شرق إفريقيا ثم انتشر إلى أجزاء أخرى من العالم ، ويتجلى في شكل نتوءات على الجلد. هذا المرض يسبب فقدان الوزن المفرط (بسبب عدم الرغبة في تناول الطعام) والحد من الحليب مؤقتا أو حتى بشكل دائم ، والحد من أو فقدان الخصوبة في الثيران والإجهاض الإناث ، وكذلك تلف دائم في الجلد. تلعب الحشرات القارضة ، وخاصة البعوض ، دورا …
معرفة المزيد عن بكتيريا الليجيونيلا من بين أنواع Legionella ، تمتلك Legionella pneumophila أعلى معدل للتسبب في البشر. تسبب هذه البكتيريا داء الفيالقة (داء الفيالقة). داء الفيلقيات هو نوع من الالتهاب الرئوي الحاد الذي يمكن أن يكون قاتلا إذا ترك دون علاج. هناك أيضا شكل أكثر اعتدالا من المرض ، يعرف باسم حمى بونتياك ، وهو مشابه للأنفلونزا. تحدث العدوى التي تسببها بكتيريا الفيلقية عندما يتم استنشاق المياه الملوثة (في شكل الهباء الجوي) وتدخل الرئتين. على سبيل المثال ، عند الاستحمام أو من خلال تكييف الهواء. أعراض عدوى الليجيونيلا پیش از اینکه به سراغ روشهای تشخیص و شناسایی باکتری لژیونلا برویم، بهتر است به این …
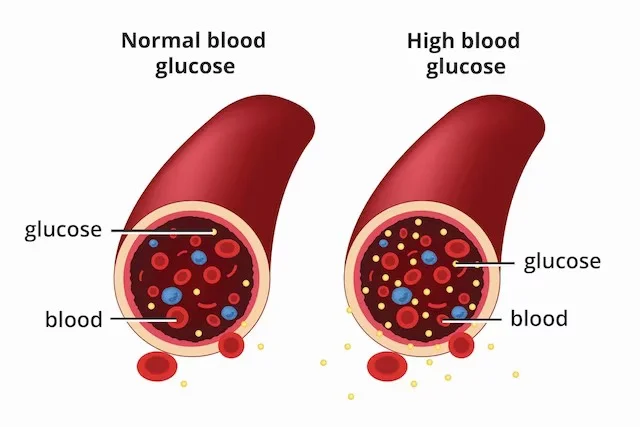
يحدث مرض السكري عندما يكون مستوى الجلوكوز في الدم أو سكر الدم مرتفعا جدا ، وعندما يكون لديك مرض السكري ، لا ينتج جسمك أي أنسولين أو لا ينتج كمية كافية من الأنسولين في الجسم. أنواع مختلفة من مرض السكري: داء السكري من النوع 1 وداء السكري من النوع 2 وسكري الحمل. يحتاج الأشخاص المصابون بداء السكري ، وخاصة مرض السكري من النوع 1 ، إلى تناول الأنسولين كل يوم للبقاء على قيد الحياة. حقن الأنسولين قد تجعل العديد من مرضى السكري ينسون ذلك. نظرا لأهمية هذه المشكلة ، طور باحثو ستانفورد نظام توصيل هيدروجيل يقلل من الحاجة إلى حقن الدواء ثلاث مرات في السنة …
في عام 2021 ، تم نشر ورقة بحثية بعنوان “تحديد الخصائص الجينية والبيولوجية لفيروسات أنفلونزا الطيور H7N9 بعد لقاح الدواجن H7N9 في الصين” ، والتي اقترحت أن فيروس أنفلونزا الطيور H7N9 (AIV) الذي ظهر في الصين تسبب في خمس إصابات بشرية ، وفي سبتمبر 2017 تم منع الحالات البشرية بواسطة لقاح H7N9 في الطيور. فيروسات H7N9 مميتة جدا للدجاج وتسبب عدوى خفيفة في البط. وجد الباحثون أن AIV H7N9 المعزول في عام 2019 يختلف مستضديا عن سلالة لقاح H7N9 ، لذلك لا يمكن منع تكاثر هذه الفيروسات تماما في الدجاج الملقح. في الدراسة الحالية ، قمنا بتقييم الخصائص الجينية والبيولوجية ل H7N9 HpAIV المكتشفة في …
عقدت جامعة إيران للعلوم الطبية المؤتمر الوطني العاشر والمؤتمر الدولي الثالث لعلم الأوبئة الإيرانية في الفترة من 8 إلى 10 ديسمبر 1402 في مركز الرازي الدولي للمؤتمرات، والذي حضره 700 مشارك وأستاذ وأطباء ومتخصصين وطالب من جميع أنحاء العالم. دولة. وقال الدكتور عبد الرضا بازوكي، رئيس جامعة إيران للعلوم الطبية ورئيس المؤتمر، عن أسباب وضرورة عقد هذا المؤتمر: المؤتمر القادم هو فرصة لاستعراض إنجازات علم الأوبئة في القرن الماضي، والتحديات المقبلة في القرن القادم، الدروس المستفادة والاستعداد في مواجهة الأوبئة المستقبلية، استخدام التقنيات الجديدة، بما في ذلك الذكاء الاصطناعي، الأساليب الجديدة في علم الأوبئة والنماذج الإحصائية، استغلال الدراسات الأترابية، الأمراض المعدية وغير المعدية الشائعة والمهمة …
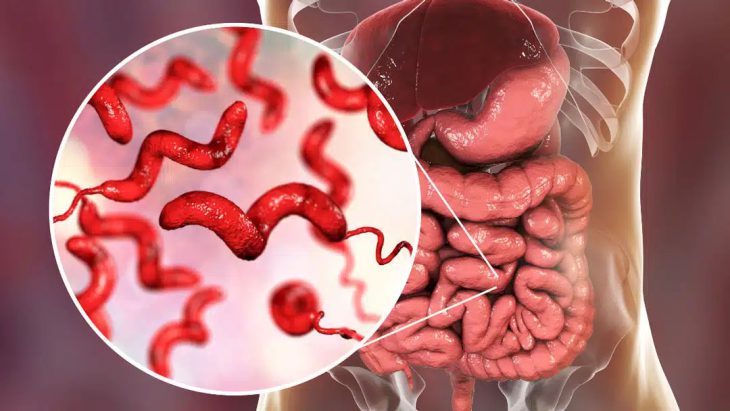
عدوى العطيفة هي واحدة من أكثر أنواع العدوى شيوعا في العالم. هذه العدوى عادة ما تؤدي إلى الإسهال والأمراض ذات الصلة. وفقا للدراسات في معظم الحالات ، تدخل عدوى العطيفة الجسم من خلال الطعام الملوث بهذه البكتيريا. لهذا السبب يوصي العلماء بتجنب اللحوم النيئة أو المطبوخة جزئيا قدر الإمكان. شركة ميلاد درو مع حقيبة PCR محمولة في الوقت الفعلي جاهزة للخدمة في قطاعي الأغذية والثروة الحيوانية. في عام 2023 ، تم نشر ورقة في اليابان عن العطيفة. العطيفة هي التسمم الغذائي الناجم عن استهلاك الأطعمة الملوثة ، وخاصة الدواجن. يعد القياس المستمر لسلالات العطيفة في الأغذية الملوثة أمرا بالغ الأهمية لتطوير التدابير الوقائية. قمنا بتطوير …
يمكن أن تحدث حالات الطوارئ المتعلقة بالعوامل البيولوجية بسبب كارثة طبيعية أو تفشي محلي (وباء) أو تفشي عالمي (جائحة) لعامل معدي. إن التحديد السريع والموثوق للعوامل البيولوجية أمر بالغ الأهمية ليس فقط لتأكيد وقوع حدث بيولوجي ، ولكن أيضا لبدء التدابير المضادة التنظيمية والطبية المناسبة. صممت ميلاد دارو منصة كشف محمولة للتعرف السريع والحساس على العوامل البيولوجية في المكان الذي يتم فيه التعامل بسهولة مع المنتج الذي تم تطويره للاستخدام من قبل موظفين غير علميين ، RT-PCR ، حتى عندما تعمل معدات الحماية في ظروف قاسية. سهل الحمل. وبالمثل ، يمكن استخدام RT-PCR مع العديد من حلول الأنظمة الأساسية المتنقلة. يعتمد المبدأ التشغيلي للكشف عن …
- 1
- 2